Hidrocarburos
Son familias de compuestos orgánicos que contienen carbono e hidrógeno. Son los compuestos orgánicos más simples y pueden ser considerados como las sustancias principales de las que se derivan todos los demás compuestos orgánicos. Los hidrocarburos se clasifican en dos grupos principales, de cadena abierta y cíclicos. En los compuestos de cadena abierta que contienen más de un átomo de carbono, los átomos de carbono están unidos entre sí formando una cadena lineal que puede tener una o más ramificaciones. En los compuestos cíclicos, los átomos de carbono forman uno o más anillos cerrados. Los dos grupos principales se subdividen según su comportamiento químico en saturados e insaturados.
ALCANOS
Los hidrocarburos saturados de cadena abierta forman un grupo homólogo denominado alcanos o parafinas. La composición de todos los miembros del grupo responde a la fórmula CnH2n +2, donde n es el número de átomos de carbono de la molécula. Los cuatro primeros miembros del grupo son el metano, CH4, el etano, C2H6, el propano, C3H8 y el butano, C4H10. Todos los miembros alcanos son inertes, es decir, no reaccionan fácilmente a temperaturas ordinarias con reactivos como los ácidos, los álcalis o los oxidantes. Los primeros cuatro miembros del grupo son gases a presión y temperatura ambiente; los miembros intermedios son líquidos, y los miembros más pesados son semisólidos o sólidos. El petróleo contiene una gran variedad de hidrocarburos saturados, y los productos del petróleo como la gasolina, el aceite combustible, los aceites lubricantes y la parafina consisten principalmente en mezclas de estos hidrocarburos que varían de los líquidos más ligeros a los sólidos.
Y la terminación de los alcanos es ANO
ALQUENOS
Los alquenos son una clase de hidrocarburos que contienen por lo menos un enlace doble carbono-carbono. Estos compuestos también se conocen con otros nombres: etilénicos (debido al etileno, el mas simple de los alquenos); olefinas (ya que el primer nombre que recibió el etileno fue el de gas olefinante); y no saturados (por no estar saturados con el máximo número de carbonos posibles en la molécula).
Los alquenos tienen la fórmula empírica general CnH2n.
El ángulo mutuo entre los enlaces de los hidrógenos con el carbono es de 120° como corresponde al carácter tetrahédrico del carbono, y todos los átomos de hidrógeno están en el mismo plano, formando una estructura "planar".
Si sustituimos uno de los hidrógenos con el radical metilo (-CH3) obtenemos el propeno o propileno CH3CH=CH2.
Las consecuentes sustituciones/adiciones de radicales van dando la posibilidad de obtener estructuras con diferentes posiciones del doble enlace dentro de la molécula y además a la formación de complejas estructuras ramificadas.
Para poner orden a la denominación de los alquenos la IUPAC (International Union of Pure and Applied Chemistry) acordó seleccionar la cadena mas larga presente en la molécula que contenga el enlace doble, y cambiar la terminación -ano dada al alcano correspondiente por la terminación -eno. La posición del doble enlace en la cadena se señala con un número, contado a partir de final de la cadena y que haga este número lo menor posible.
Cuando hay mas de un doble enlace en la molécula, se utiliza la terminación -dieno (para dos dobles enlaces), -trieno (para tres) y así sucesivamente en el lugar de la terminación -eno.
ALQUINOS
Bajo el término de alquinos se encuentran aquellos hidrocarburos alifáticos no saturados que tienen un enlace triple en la molécula. La fórmula empírica general de los alquinos es CH2H2n-2. Se conocen también como acetilenos, al ser el gas acetileno (HC≡CH), el mas simple de los alquinos.
La molécula del acetileno es lineal, igualmente son lineales aquellas moléculas producto de la sustitución, R-C≡C-R, por tal motivo la existencia de isómeros cis y trans no es posible.
La IUPAC (International Union of Pure and Applied Chemistry), ha establecido que para nombrar los alquinos se sustituya la terminación -ano de los homólogos alcanos por -ino, indicando con números la posición del carbono con el triple enlace de la cadena mas larga encontrada. En la tabla 1 aparecen algunos compuestos representativos y sus nombres.
HIDROCARBUROS AROMÁTICOS
Los hidrocarburos aromáticos al igual que todo hidrocarburo está compuesto por carbono e hidrógeno. Son del tipo no saturado, pueden combinarse en múltiples cantidades de átomos de carbono y han recibido ese nombre porque la mayoría de ellos presentan un olor agradable.
La estructura de estos hidrocarburos estuvo durante muchos años sin explicación; resulta que cuando se determinó la relación entre la cantidad de carbono y de hidrógeno de estas sustancias existía un grave problema, las proporciones encontradas no correspondían a ninguna forma de enlace posible para la valencia 1 del hidrógeno y la 4 del carbono, según se establecía en la reglas de Kelulé.
La mas simple de estas sustancias es el benceno que tiene 6 carbonos y 6 hidrógenos (C₆H₆), este problema inquietó a los químicos hasta que que se propuso la idea de la estructura de resonancia, que consiste en que los átomos de carbono forman un anillo exagonal con cada átomo enlazado a un hidrógeno y un doble enlace entre carbonos que se permuta constantemente de átomo a átomo. 
ALCOHOLES
Alcoholes son aquellos compuestos orgánicos en cuya estructura se encuentra el grupo hidroxilo (-OH), unido a un carbono que solo se acopla a otro carbono o a hidrógenos.
Pueden ser alifáticos (R-OH) o aromáticos (Ar-OH) estos últimos se conocen como fenoles.
Son un grupos de compuestos muy importantes, no solo por su utilidad industrial, de laboratorio, teórica, o comercial, si no también, porque se encuentran muy extensamente en la vida natural.
Cuando en la molécula del alcohol hay mas de un grupo hidroxilo se les llama polioles o alcoholes polihídricos. Si son dos grupos hidroxilos se llaman glicoles, tres, gliceroles, cuatro tetrioles y así sucesivamente. NOMENCLATURA.
Es común que los alcoholes se nombren usando la palabra alcohol como nombre, y con el "apellido" del grupo correspondiente a los alcanos básicos que le dan lugar, esta nomenclatura se ilustra a continuación. También existe la denominación de la IUPAC (International Union of Pure and Applied Chemistry) que resulta necesaria para los alcoholes con estructura mas compleja.
Según la IUPAC para nombrar los alcoholes se utiliza la terminación -ol al final de la nomenclatura raíz del homólogo correspondiente de los alcanos.
Los alcoholes también pueden tener anillos cerrados en la estructura, en este caso se les coloca el prefijo ciclo delante del nombre.
A su vez los alcoholes pueden ser primarios, secundarios o terciarios, en dependencia de la cantidad de carbonos acoplados a aquel que tiene el grupo hidroxilo
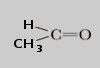
ALDEHÍDOS
Los aldehídos constituyen una clase de sustancias orgánicas que presentan el grupo funcional carbonilo 
dentro de la estructura de la molécula, acoplado a por lo menos un átomo de hidrógeno. Pueden ser alifáticos o aromáticos en dependencia de si el grupo funcional se acopla a un radical alquilo (R) o arilo (Ar) respectivamente, por el otro enlace disponible.


FENOLES
Cuando uno de los hidrógenos de la estructura molecular de los hidrocarburos aromáticos se sustituye por el grupo hidroxilo (-OH), característico de los alcoholes, se les denomina fenoles.
El mas simple de los hidrocarburos aromáticos es el benceno (C6H6), de estructura de resonancia en forma de anillo hexagonal. Cuando uno de los hidrógenos del benceno se sustituye por un grupo hidroxilo obtenemos el Fenol, el mas simple de los fenoles y al cual debe el nombre la clase. En la figura 1 se muestran las dos formas de resonancia del benceno, para simplificar la representación es común que el anillo bencénico se represente como se muestra en la figura 2. Allí aparece también como se representa el fenol utilizando el mismo procedimiento. Note que uno de los hidrógenos en los vértices de hexágono se ha sustituido por un grupo hidroxilo.
Los fenoles presentan algunas características comunes con los alcoholes pero se diferencian en otras muchas por eso son tratados como una clase aparte.
Cuando dos hidrógenos del anillo del benceno se sustituyen por grupos hidroxilos, se dice que son dihídricos, y en general reciben nombres comunes (figura3)
imagen 1
Imagen 2
imagen 3
Los fenoles además pueden tener varios anillos bencénicos (policíclicos) en la estructura molecular y acoplarse de diversa manera con diferentes radicales en los vértices de los hexágonos del anillo para formar compuestos de elevada complejidad y características muy diferentes.
Cetonas:
en la estructura molecular, pero en este caso, en los dos enlaces disponibles del grupo carbonilo se acoplan radicales tipo hidrocarburo.
Las cetonas pueden ser simétricas o asimétricas en dependencia de si los dos radicales son iguales o diferentes (figura 1).
La acetona, CH3COCH3, es el primer miembro de la clase de cetonas alifáticas mientras que la benzofenona y la acetofenona son las mas simples de las cetonas diarílicas y las alquilo arilícas respectivamente.
Fuentes naturales y usos de las cetonas.
Las cetonas se encuentran ampliamente distribuidas en la naturaleza. El importante carbohidrato fructuosa, las hormonas cortisona, testosterona (hormona masculina) y progesterona (hormona femenina) son también cetonas, así como el conocido alcanfor usado como medicamento tópico.
La acetona y metil-etil-cetona se usan extensamente en la industria como disolventes.
En la vida doméstica la acetona es el disolvente por excelencia para las pinturas de uñas y una mezcla de ambas se usa como disolvente-cemento de los tubos de PVC. Ácidos carboxílicos
Los ácidos carboxílicos se caracterizan por tener en su estructura el grupo carboxilo:

Ellos pueden ser alifáticos RCOOH, aromáticos ArCOOH o heterocíclicos y a su vez pueden ser di- y policarboxílicos en dependencia de la cantidad de grupos carboxilo —COOH en la molécula. Estos ácidos también pueden poseer otros grupos funcionales.
Los ácidos carboxílicos abundan en la naturaleza y tienen basta aplicación industrial, el ácido acético, componente ácido principal del vinagre es el mas utilizado en la industria; es utilizado como disolvente y en la fabricación de plásticos, gomas, medicamentos y una gran variedad de compuestos orgánicos. El ácido cítrico es el que proporciona la acidez a los cítricos y se usa ampliamente para acidular bebidas. Podemos encontrar otros muchos ejemplos de la ocurrencia de estos ácidos en la naturaleza. En adición, los derivados de los ácidos carboxílicos, particularmente los ésteres y la amidas, están ampliamente distribuidos naturalmente y son de gran importancia e interés debido a sus funciones y usos. Nomenclatura y propiedades físicas de los ácidos carboxílicos
Los nombres de los ácidos carboxílicos alifáticos se obtienen sustituyendo la terminación -o del correspondiente alcano y agregando el sufijo -oico precedido todo por la palabra ácido. En la tabla 1 se dan algunos ejemplos: Tabla 1: Propiedades físicas de algunos ácidos carboxílicos alifáticos
Estructura | Nombre técnico
(Ácido ―) | Nombre común
(Ácido ―) | Punto de ebullición
ºC | Punto de fusión
ºC |
HCOOH | Metanoico | Fórmico | 101 | 8.4 |
CH3 COOH | Etanoico | Acético | 118 | 16 |
CH3CH2COOH | Propanoico | Propiónico | 142 | - 21 |
CH3CH2CH2COOH | Butanoico | Butírico | 164 | - 5 |
(CH3)2CHCOOH | 2-metilpropanoico | Isobutírico | 154 | - 47 |
CH3(CH2)3COOH | Pentanoico | Valérico | 186 | - 35 |
CH3(CH2)6COOH | Octanoico | Caprílico | 239 | 16 |
CH3(CH2)14COOH | Hexadecanoico | Palmítico | 139/1mm | 63 |
CH3(CH2)16COOH | Octadecanoico | Esteárico | 160/1mm | 69 |
Los nombres comunes de los ácidos carboxílicos reflejan su origen histórico en fuentes naturales. Esto resulta evidente en nombres como fórmico (Latín: formica, hormiga), acético (Latín: acetum, vinagre), palmítico (aceite de palma). Los ácidos alifáticos normales de longitud de cadena CH3(CH2)nCOOH (n= de 12 a 20), aparecen como ésteres en las grasas y aceites naturales tanto animales como vegetales. De ahí que se denominen como ácidos grasos, nombre que se usa en general para los ácidos carboxílicos de la serie alifáticos. AMINAS
Casi todos los compuestos orgánicos vistos hasta ahora son bases, aunque muy débiles Gran parte de la química de los alcoholes, éteres, ésteres y aun alquenos e hidrocarburos aromáticos puede comprenderse en función de la basicidad de estos compuestos. De las sustancias orgánicas que muestran basicidad apreciable (por ejemplo, aquellas con fuerza suficiente para azulear al tornasol), las más importantes son las aminas. Una amina tiene la fórmula general RNH2, R2nh o R3N, donde R es un grupo alquilo o arilo. Clasificación

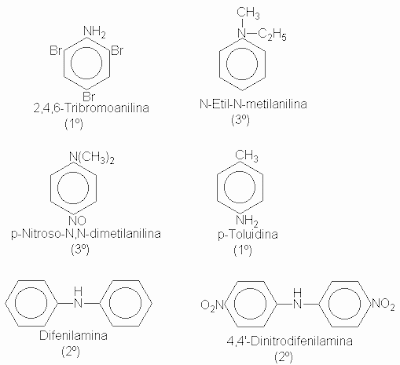
Las aminas se clasifican en primarias, secundarias o terciarias, según el número de grupos que se unen al nitrógeno. En relación con sus propiedades fundamentales basicidad y la nucleofilicidad que la acompañan-, las aminas de tipo diferentes son prácticamente iguales. Sin embargo, en muchas de sus reacciones, los productos finales dependen del número de átomos de hidrógeno unidos al de nitrógeno, por esa razón son diferentes para aminas de distintos tipos. Las aminas alifáticas se nombran por el grupo, o grupos, alquilo unido al nitrógeno seguido de la palabra amina. Las más complejas se suelen nombrar colocando junto al nombre de la cadena matriz el prefijo amino (o N-metilamino, N,N-dimetilamino, etc.). Las aminas aromáticas, donde el nitrógeno está directamente unido a un anillo aromático, por lo general se nombran como derivados de la más sencilla de ellas, la anilina. Un aminotolueno recibe la denominación especial de toluidina. Por ejemplo:
Las sales de las aminas suelen tomar su nombre al reemplazar amina por amonio (o anilina por anilino) y anteponer el nombre del anión (cloruro de, nitrato de, sulfato de, etc.).
Como el amoniaco, las aminas son compuestos polares y pueden formar puentes de hidrógeno intermoleculares, salvo las terciarias. Las aminas tienen puntos de ebullición más altos que los compuestos no polares de igual peso molecular, pero inferiores a los de alcoholes o ácidos carboxílicos. Los tres tipos de aminas pueden formar enlaces de hidrógeno con el agua. Como resultados, las aminas menores son bastantes solubles en agua y tienen solubilidad límite al tomar unos seis átomos de carbono. Son solubles en disolventes menos polares, como éter, alcohol, benceno, etc. Las metil y etilaminas huelen muy semejante al amoniaco. Las alquilaminas superiores tienen olor a pescado en descomposición. Las aminas aromáticas suelen ser muy tóxicas, ya que son absorbidas por la piel, con resultados a menudo fatales. Las aminas aromáticas se oxidan fácilmente al aire y con frecuencia se las encuentra coloreadas por productos de oxidación, aunque son incoloras cuando están puras.
Bibliografia:
Quimica. Hein. Grupo editorial iberoamericana.
Química Organica. Morrison Boyd. Pearson educación